Senin, 09 Desember 2019
Kamis, 05 Desember 2019
Senin, 25 November 2019
PEMBAHASAN SOAL PTS GANJIL SIFAT KOLIGATIF LARUTAN
KD. 3.6-4.6
MATERI : PEMBAHASAN SOAL-SOAL PAS GANJIL 2018/2019
SIFAT KOLIGATIF LARUTAN
SIFAT KOLIGATIF LARUTAN
KELAS : 12 IPA 1,2,3
PERTEMUAN : 5
Jumat, 22 November 2019
Pembahasan soal pas
KD. 3.5-4.5
MATERI : PEMBAHASAN SOAL-SOAL PAS GANJIL 2018/2019
KELAS : 10 IPA 1
PERTEMUAN : 4
Rabu, 20 November 2019
Pembahasan soal PAS
KD. 3.5-4.5
MATERI : PEMBAHASAN SOAL-SOAL PAS GANJIL 2018/2019
KELAS : 10 IPA 4
PERTEMUAN : 4
Selasa, 19 November 2019
Pembahasan soal pts
KD. 3.6-4.6
MATERI : PEMBAHASAN SOAL-SOAL PAS GANJIL 2018/2019
SEL ELEKTROLISIS, HUKUM FARADAY 1 DAN 2, KIMIA UNSUR
SEL ELEKTROLISIS, HUKUM FARADAY 1 DAN 2, KIMIA UNSUR
KELAS : 12 IPA 2
PERTEMUAN : 4
Senin, 18 November 2019
Kamis, 14 November 2019
Ikatan kimia "bentuk molekul"
KD. 3.5-4.5
Materi : ikatan kimia "bentuk molekul "
Pertemuan ke : 4
Kelas : X IPA 2, X IPA 3
Bentuk Molekul Teori Domain Elektron
Metode yang dapat digunakan untuk meramalkan bentuk molekul adalah model rumus titik elektron yang diperluas menjadi teori domain elektron atau teori tolakan pasangan elektron kulit valensi (VSEPR, Valence Shell Electron Pair Repulsion). Seperangkat aturan dikemas ke dalam teori domain elektron yang memungkinkan Anda dapat meramalkan bentuk molekul secaratepat. Teori ini didasarkan pada jumlah pasangan elektron ikatan dan pasangan elektron bebas dalam kulit valensi atom pusat suatu molekul. Teori ini menyatakan bahwa bentuk molekul dapat ditentukan berdasarkan tolakan pasangan elektron dalam kulit valensi atom pusat. Oleh karena itu, teori ini disebut domain elektron atau VSEPR. Bagaimana teori ini dapat diterapkan untuk memprediksi bentuk suatu molekul? Untuk mempermudah mempelajarinya, molekul-molekul dikelompokkan ke dalam tiga kategori, yaitu molekul-molekul yang memiliki atom pusat:
1. berikatan kovalen tunggal yang jenuh;
2. berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas);
3. berikatan kovalen rangkap.
2. berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas);
3. berikatan kovalen rangkap.
Dalam teori VSEPR, gaya tolakan yang dihasilkan PEB juga mempengaruhi bentuk mlekul. Notasi VSEPR yang menunjukan jumlah PEI dan PEb sebagai berikut:

Hubungan antara PEI dan PEB pada atom pusat terhadap bentu molekul disajikan dalam tabel berikut ini.

Teori Hibridilasi
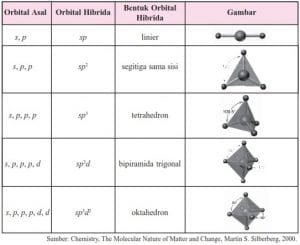
Teori hibridilasi dijelaskan berdasarkan proses penggabungan orbital-orbital atom yang digunakan oleh elektron-elektron yang saling berikata. Teori ini disebut juga teori ikatan valensi.
a. Orbital Hibrida sp
b. orbital sp2
c. orbital sp3
d. orbital sp3d dan sp3d2
b. orbital sp2
c. orbital sp3
d. orbital sp3d dan sp3d2
Secara ringkas berbagai tipe hibridasi digambarkan seperti tabel dibawah ini.
Rabu, 13 November 2019
Ikatan kimia " bentuk molekul "
KD. 3.5-4.5
Materi : ikatan kimia "bentuk molekul "
Pertemuan ke : 4
Kelas : X IPA 4
Bentuk Molekul Teori Domain Elektron
Metode yang dapat digunakan untuk meramalkan bentuk molekul adalah model rumus titik elektron yang diperluas menjadi teori domain elektron atau teori tolakan pasangan elektron kulit valensi (VSEPR, Valence Shell Electron Pair Repulsion). Seperangkat aturan dikemas ke dalam teori domain elektron yang memungkinkan Anda dapat meramalkan bentuk molekul secaratepat. Teori ini didasarkan pada jumlah pasangan elektron ikatan dan pasangan elektron bebas dalam kulit valensi atom pusat suatu molekul. Teori ini menyatakan bahwa bentuk molekul dapat ditentukan berdasarkan tolakan pasangan elektron dalam kulit valensi atom pusat. Oleh karena itu, teori ini disebut domain elektron atau VSEPR. Bagaimana teori ini dapat diterapkan untuk memprediksi bentuk suatu molekul? Untuk mempermudah mempelajarinya, molekul-molekul dikelompokkan ke dalam tiga kategori, yaitu molekul-molekul yang memiliki atom pusat:
1. berikatan kovalen tunggal yang jenuh;
2. berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas);
3. berikatan kovalen rangkap.
2. berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas);
3. berikatan kovalen rangkap.
Dalam teori VSEPR, gaya tolakan yang dihasilkan PEB juga mempengaruhi bentuk mlekul. Notasi VSEPR yang menunjukan jumlah PEI dan PEb sebagai berikut:

Hubungan antara PEI dan PEB pada atom pusat terhadap bentu molekul disajikan dalam tabel berikut ini.

Teori Hibridilasi
Teori hibridilasi dijelaskan berdasarkan proses penggabungan orbital-orbital atom yang digunakan oleh elektron-elektron yang saling berikata. Teori ini disebut juga teori ikatan valensi.
a. Orbital Hibrida sp
b. orbital sp2
c. orbital sp3
d. orbital sp3d dan sp3d2
b. orbital sp2
c. orbital sp3
d. orbital sp3d dan sp3d2
Secara ringkas berbagai tipe hibridasi digambarkan seperti tabel dibawah ini.

Senin, 11 November 2019
Pembahasan soal UN materi sel elektrokimia (hk. Faraday)
KD. 3.6-4.6
MATERI : PEMBAHASAN SOAL-SOAL UN HUKUM FARADAY 1 DAN 2
KELAS : 12 IPA 1,2,3
PERTEMUAN : 4
Hukum Faraday Pada Reaksi Sel Elektrokimia
Pengertian Hukum Faraday.
Michael Faraday adalah seorang pakar Kimia-Fisika Inggris. Faraday menyatakan bahwa sel elektrolisis dapat digunakan untuk menentukan banyaknya zat yang bereaksi berdasarkan jumlah muatan listrik yang digunakan dalam rentang waktu tertentu.
Dalam sel volta maupun sel elektrolisis terdapat hubungan kuantitatif antara jumlah zat yang bereaksi dan muatan listrik yang terlibat dalam reaksi redoks
Hukum Faraday menyatakan bahwa massa yang dihasilkan dalam suatu sistem sel elektrolisis berbanding lurus dengan muatan listrik yang mengalir dalam sel tersebut. Besarnya muatan listrik yang terjadi dalam sel merupakan hasil kali antara kuat arus yang dialirkan dengan lamanya waktu elektrolisisnya. Pernyataan ini merupakan prinsip dasar Hukum Faraday yang dapat dijelaskan sebagai berikut:
1. Dalam sel elektrokimia, massa zat yang diendapkan pada suatu elektrode sebanding dengan besarnya muatan listrik (aliran elektron) yang terlibat di dalam sel.
2. Massa ekuivalen zat yang diendapkan pada elektrode akan setara dengan muatan listrik yang dialirkan ke dalam sel.
Secara aljabar hukum Faraday I dapat diformulasikan sebagai berikut:
w = (e i t)/F
w = massa zat, gram
e = massa ekuivalen atau (M/valensi)
i = kuat arus, ampere
F = tetapan Faraday = 96.500 coulumb
1 F = satu mol elektron
Contoh Perhitungan Hukum Faraday Pada Sel Elektrolisis
Berapakah massa tembaga yang diendapkan di katode pada elektrolisis larutan CuSO4 dengan menggunakan kuat arus 2 A selama 20 menit. (diketahui bahwa massa atom relatif tembaga adalah ArCu = 63,5 g/mol)
Jawab
Di katode akan terjadi reaksi reduksi ion Cu2+ menjadi logam Cu seperti reaksi berikut:
Cu2+(aq) + 2 e– –>Cu(s)
Pada Reaksi ini, ion-ion Cu2+ yang terdapat dalam larutan akan tereduksi kemudian terendapkan dan membentuk tembaga logam pada katoda. Jumlah tembaga logam yang terendapkan akan tergantung pada lamanya dan arus yang digunakan.
e = (63,5 g/mol)/2
t = 20 menit = 1.200 s
w =( e i t)/ F
w = { [(63,5 g/mol)/2] × 2 A ×1.200 s}/96.500 coulumb
= 0,79 g
Dengan demikian, massa tembaga yang diendapkan pada katode adalah 0,79 gram
Jumat, 08 November 2019
Ikatan kimia
Ikatan kimia
KD. 3.5-4.5
MATERI: IKATAN KIMIA
KELAS : X IPA 1,2
Pertemuan : 3
Teori Lewis: Teori tentang Ikatan Kimia

Teori tentang ikatan kimia lahir dari gagasan Profesor Fisika dan Kimia dari Amerika Serikat yaitu Gilbert. N. Lewis. Dalam artikelnya di tahun 1916 tentang “The atom and the molecules”, Lewis meneliti tentang kesulitan golongan gas mulia (VIIIA) membentuk suatu ikatan kimia. Diduga bila gas mulia bersenyawa dengan unsur lain, tentunya ada suatu keunikan dalam konfigurasi elektronnya yang dapat mencegah persenyawaan dengan unsur-unsur lain.
Apabila dugaan tersebut benar, maka suatu atom yang bergabung dengan atom lain membentuk suatu senyawa yang mungkin mengalami perubahan dalam konfigurasi elektronnya sehingga mengakibatkan atom-atom tersebut lebih menyerupai gas mulia. Berdasarkan gagasan itu, lahirlah suatu teori yang disebut Teori Lewis, yaitu:
a. Elektron-elektron yang berada pada kulit terluar (dikenal sebagai elektron valensi)memegang peranan utama dalam pembentukan ikatan kimia.
b. Pembentukan ikatan kimia mungkin terjadi dengan 2 cara:
- Karena adanya perpindahan satu atau lebih elektron dari satu atom ke atom lain sedemikian rupa sehingga terdapat ion positif dan ion negatif dan keduanya saling tarik-menarik karena muatannya yang saling berlawanan akan membentuk ikatan ion.
- Karena adanya pemakaian bersama pasangan elektron di antara atom-atom yang berikatan. Jenis ikatan yang terbentuk disebut ikatan kovalen.
c. Perpindahan elektron atau pemakaian bersama pasangan elektron berlangsung sedemikian rupa sehingga setiap atom yang berikatan mempunyai suatu konfigurasi elektron yang stabil yaitu konfigurasi dengan 8 elektron valensi.
Jenis-jenis Ikatan Kimia

Ikatan kimia terdiri dari 3 jenis ikatan yaitu ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan ionadalah ikatan yang terjadi berdasarkan serah terima atau perpindahan elektronnya, ikatan ini terjadi antara ion positif dan ion negatif dan juga antara unsur logam dan non logam, serta antara unsur golongan IA dan IIA (+), golongan VIA dan VIIA(-). Contoh senyawa ion antara lain: NaCl, MgCl2, CaCl2, KOH, KCl, dan lainnya.
Ikatan kovalen adalah ikatan yang terjadi berdasarkan pemakaian pasangan elektron bersama, ikatan ini terjadi antara unsur non-logam dan non-logam. Ikatan kovalen memiliki 3 jenis yaitu ikatan kovalen biasa, ikatan kovalen rangkap, dan ikatan kovalen koordinat. Contoh ikatan kovalen antara lain: H20, HF, HCl, CO2, NH3, Cl2, I2, Br2, O2, dan lainnya.
Ikatan logamadalah ikatan yang terjadi antar atom-atom unsur logam. Ikatan ini terjadi antara elektron valensi logam yang membentuk elektron valensi. Ikatan logam dapat menjadikan suatu logam yang keras namun lentur, tidak mudah patah meski ditempa, titik leleh dan titik didih yang tinggi, dan nilai konduktor listrik dan panas yang baik.
Contoh dari jalan terjadinya ikatan ion adalah saat Atom Natrium berikatan dengan atom Clorida dan saat Calsium berikatan dengan Sulfurida. Konfigurasi elektronnya adalah sebagai berikut:
1. Atom Natrium berikatan dengan atom Clorida dan saat Calsium berikatan dengan Sulfurida
11Na → 2 8 1 (Na akan membentuk ion positif dan memberi elektron kepada Cl agar mencapai kestabilan)
17Cl → 2 8 7 ( Cl akan membentuk ion negative dan menerima elektron dari Na agar mencapai kestabilan)
Reaksi yang dapat dituliskan:
Na → Na+ + e 2 . 8
Cl + e → Cl– 2. 8. 8
Rumus Molekul:
Na+ + Cl– → NaCl(Hasil akhir adalah terbentuknya senyawa NaCl yangstabil)
17Cl → 2 8 7 ( Cl akan membentuk ion negative dan menerima elektron dari Na agar mencapai kestabilan)
Reaksi yang dapat dituliskan:
Na → Na+ + e 2 . 8
Cl + e → Cl– 2. 8. 8
Rumus Molekul:
Na+ + Cl– → NaCl(Hasil akhir adalah terbentuknya senyawa NaCl yangstabil)
2. Atom Ca berikatan dengan atom S
Konfigurasi elektronnya adalah sebagai berikut:
20Ca → 2 8 8 2 ( Ca akan membentuk ion positif dan memberi elektron kepada S agar mencapai kestabilan).
16S → 2 8 6 ( S akan membentuk ion negatif dan menerima elektron dari Ca agar mencapai kestabilan).
Reaksi yang dapat dituliskan:
Ca → Ca2+ + 2e 2 . 8. 8
S + 2e → S2- 2. 8. 8
Rumus Molekul:
Ca2++ S2- → CaS (Hasil akhir adalah terbentuknya senyawa CaS yang stabil)
20Ca → 2 8 8 2 ( Ca akan membentuk ion positif dan memberi elektron kepada S agar mencapai kestabilan).
16S → 2 8 6 ( S akan membentuk ion negatif dan menerima elektron dari Ca agar mencapai kestabilan).
Reaksi yang dapat dituliskan:
Ca → Ca2+ + 2e 2 . 8. 8
S + 2e → S2- 2. 8. 8
Rumus Molekul:
Ca2++ S2- → CaS (Hasil akhir adalah terbentuknya senyawa CaS yang stabil)
Jenis-jenis Ikatan Kovalen

Penulisan suatu ikatan kovalen didasarkan pada rumus Lewisdan rumus bangun/struktur molekul. Rumus lewis (rumus elektron)adalah rumus yang menggambarkan bagaimana keadaan elektron-elektron valensi atom-atom saling berpapasan dan saling berikatan secara kovalen. Sedangkan rumus bangun (struktur molekul)adalah rumus yang menggambarkan bagaimana cara ikatan kovalen yang digunakan atom-atom.
Kamis, 07 November 2019
Ikatan kimia
Ikatan kimia
KD. 3.5-4.5
MATERI: IKATAN KIMIA
KELAS : X IPA 2-3
Pertemuan : 3
Teori Lewis: Teori tentang Ikatan Kimia

Teori tentang ikatan kimia lahir dari gagasan Profesor Fisika dan Kimia dari Amerika Serikat yaitu Gilbert. N. Lewis. Dalam artikelnya di tahun 1916 tentang “The atom and the molecules”, Lewis meneliti tentang kesulitan golongan gas mulia (VIIIA) membentuk suatu ikatan kimia. Diduga bila gas mulia bersenyawa dengan unsur lain, tentunya ada suatu keunikan dalam konfigurasi elektronnya yang dapat mencegah persenyawaan dengan unsur-unsur lain.
Apabila dugaan tersebut benar, maka suatu atom yang bergabung dengan atom lain membentuk suatu senyawa yang mungkin mengalami perubahan dalam konfigurasi elektronnya sehingga mengakibatkan atom-atom tersebut lebih menyerupai gas mulia. Berdasarkan gagasan itu, lahirlah suatu teori yang disebut Teori Lewis, yaitu:
a. Elektron-elektron yang berada pada kulit terluar (dikenal sebagai elektron valensi)memegang peranan utama dalam pembentukan ikatan kimia.
b. Pembentukan ikatan kimia mungkin terjadi dengan 2 cara:
- Karena adanya perpindahan satu atau lebih elektron dari satu atom ke atom lain sedemikian rupa sehingga terdapat ion positif dan ion negatif dan keduanya saling tarik-menarik karena muatannya yang saling berlawanan akan membentuk ikatan ion.
- Karena adanya pemakaian bersama pasangan elektron di antara atom-atom yang berikatan. Jenis ikatan yang terbentuk disebut ikatan kovalen.
c. Perpindahan elektron atau pemakaian bersama pasangan elektron berlangsung sedemikian rupa sehingga setiap atom yang berikatan mempunyai suatu konfigurasi elektron yang stabil yaitu konfigurasi dengan 8 elektron valensi.
Jenis-jenis Ikatan Kimia

Ikatan kimia terdiri dari 3 jenis ikatan yaitu ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan ionadalah ikatan yang terjadi berdasarkan serah terima atau perpindahan elektronnya, ikatan ini terjadi antara ion positif dan ion negatif dan juga antara unsur logam dan non logam, serta antara unsur golongan IA dan IIA (+), golongan VIA dan VIIA(-). Contoh senyawa ion antara lain: NaCl, MgCl2, CaCl2, KOH, KCl, dan lainnya.
Ikatan kovalen adalah ikatan yang terjadi berdasarkan pemakaian pasangan elektron bersama, ikatan ini terjadi antara unsur non-logam dan non-logam. Ikatan kovalen memiliki 3 jenis yaitu ikatan kovalen biasa, ikatan kovalen rangkap, dan ikatan kovalen koordinat. Contoh ikatan kovalen antara lain: H20, HF, HCl, CO2, NH3, Cl2, I2, Br2, O2, dan lainnya.
Ikatan logamadalah ikatan yang terjadi antar atom-atom unsur logam. Ikatan ini terjadi antara elektron valensi logam yang membentuk elektron valensi. Ikatan logam dapat menjadikan suatu logam yang keras namun lentur, tidak mudah patah meski ditempa, titik leleh dan titik didih yang tinggi, dan nilai konduktor listrik dan panas yang baik.
Contoh dari jalan terjadinya ikatan ion adalah saat Atom Natrium berikatan dengan atom Clorida dan saat Calsium berikatan dengan Sulfurida. Konfigurasi elektronnya adalah sebagai berikut:
1. Atom Natrium berikatan dengan atom Clorida dan saat Calsium berikatan dengan Sulfurida
11Na → 2 8 1 (Na akan membentuk ion positif dan memberi elektron kepada Cl agar mencapai kestabilan)
17Cl → 2 8 7 ( Cl akan membentuk ion negative dan menerima elektron dari Na agar mencapai kestabilan)
Reaksi yang dapat dituliskan:
Na → Na+ + e 2 . 8
Cl + e → Cl– 2. 8. 8
Rumus Molekul:
Na+ + Cl– → NaCl(Hasil akhir adalah terbentuknya senyawa NaCl yangstabil)
17Cl → 2 8 7 ( Cl akan membentuk ion negative dan menerima elektron dari Na agar mencapai kestabilan)
Reaksi yang dapat dituliskan:
Na → Na+ + e 2 . 8
Cl + e → Cl– 2. 8. 8
Rumus Molekul:
Na+ + Cl– → NaCl(Hasil akhir adalah terbentuknya senyawa NaCl yangstabil)
2. Atom Ca berikatan dengan atom S
Konfigurasi elektronnya adalah sebagai berikut:
20Ca → 2 8 8 2 ( Ca akan membentuk ion positif dan memberi elektron kepada S agar mencapai kestabilan).
16S → 2 8 6 ( S akan membentuk ion negatif dan menerima elektron dari Ca agar mencapai kestabilan).
Reaksi yang dapat dituliskan:
Ca → Ca2+ + 2e 2 . 8. 8
S + 2e → S2- 2. 8. 8
Rumus Molekul:
Ca2++ S2- → CaS (Hasil akhir adalah terbentuknya senyawa CaS yang stabil)
20Ca → 2 8 8 2 ( Ca akan membentuk ion positif dan memberi elektron kepada S agar mencapai kestabilan).
16S → 2 8 6 ( S akan membentuk ion negatif dan menerima elektron dari Ca agar mencapai kestabilan).
Reaksi yang dapat dituliskan:
Ca → Ca2+ + 2e 2 . 8. 8
S + 2e → S2- 2. 8. 8
Rumus Molekul:
Ca2++ S2- → CaS (Hasil akhir adalah terbentuknya senyawa CaS yang stabil)
Jenis-jenis Ikatan Kovalen

Penulisan suatu ikatan kovalen didasarkan pada rumus Lewisdan rumus bangun/struktur molekul. Rumus lewis (rumus elektron)adalah rumus yang menggambarkan bagaimana keadaan elektron-elektron valensi atom-atom saling berpapasan dan saling berikatan secara kovalen. Sedangkan rumus bangun (struktur molekul)adalah rumus yang menggambarkan bagaimana cara ikatan kovalen yang digunakan atom-atom.
Hk. FARADAY
KD. 3.6-4.6
MATERI : HUKUM FARADAY
KELAS : 12 IPA 1
PERTEMUAN : 3
Hukum Faraday Pada Reaksi Sel Elektrokimia
Pengertian Hukum Faraday.
Michael Faraday adalah seorang pakar Kimia-Fisika Inggris. Faraday menyatakan bahwa sel elektrolisis dapat digunakan untuk menentukan banyaknya zat yang bereaksi berdasarkan jumlah muatan listrik yang digunakan dalam rentang waktu tertentu.
Dalam sel volta maupun sel elektrolisis terdapat hubungan kuantitatif antara jumlah zat yang bereaksi dan muatan listrik yang terlibat dalam reaksi redoks
Hukum Faraday menyatakan bahwa massa yang dihasilkan dalam suatu sistem sel elektrolisis berbanding lurus dengan muatan listrik yang mengalir dalam sel tersebut. Besarnya muatan listrik yang terjadi dalam sel merupakan hasil kali antara kuat arus yang dialirkan dengan lamanya waktu elektrolisisnya. Pernyataan ini merupakan prinsip dasar Hukum Faraday yang dapat dijelaskan sebagai berikut:
1. Dalam sel elektrokimia, massa zat yang diendapkan pada suatu elektrode sebanding dengan besarnya muatan listrik (aliran elektron) yang terlibat di dalam sel.
2. Massa ekuivalen zat yang diendapkan pada elektrode akan setara dengan muatan listrik yang dialirkan ke dalam sel.
Secara aljabar hukum Faraday I dapat diformulasikan sebagai berikut:
w = (e i t)/F
w = massa zat, gram
e = massa ekuivalen atau (M/valensi)
i = kuat arus, ampere
F = tetapan Faraday = 96.500 coulumb
1 F = satu mol elektron
Contoh Perhitungan Hukum Faraday Pada Sel Elektrolisis
Berapakah massa tembaga yang diendapkan di katode pada elektrolisis larutan CuSO4 dengan menggunakan kuat arus 2 A selama 20 menit. (diketahui bahwa massa atom relatif tembaga adalah ArCu = 63,5 g/mol)
Jawab
Di katode akan terjadi reaksi reduksi ion Cu2+ menjadi logam Cu seperti reaksi berikut:
Cu2+(aq) + 2 e– –>Cu(s)
Pada Reaksi ini, ion-ion Cu2+ yang terdapat dalam larutan akan tereduksi kemudian terendapkan dan membentuk tembaga logam pada katoda. Jumlah tembaga logam yang terendapkan akan tergantung pada lamanya dan arus yang digunakan.
e = (63,5 g/mol)/2
t = 20 menit = 1.200 s
w =( e i t)/ F
w = { [(63,5 g/mol)/2] × 2 A ×1.200 s}/96.500 coulumb
= 0,79 g
Dengan demikian, massa tembaga yang diendapkan pada katode adalah 0,79 gram
Rabu, 06 November 2019
Hk FARADAY
KD. 3.6-4.6
MATERI : HUKUM FARADAY
KELAS : 12 IPA 3
PERTEMUAN : 3
Hukum Faraday Pada Reaksi Sel Elektrokimia
Pengertian Hukum Faraday.
Michael Faraday adalah seorang pakar Kimia-Fisika Inggris. Faraday menyatakan bahwa sel elektrolisis dapat digunakan untuk menentukan banyaknya zat yang bereaksi berdasarkan jumlah muatan listrik yang digunakan dalam rentang waktu tertentu.
Dalam sel volta maupun sel elektrolisis terdapat hubungan kuantitatif antara jumlah zat yang bereaksi dan muatan listrik yang terlibat dalam reaksi redoks
Hukum Faraday menyatakan bahwa massa yang dihasilkan dalam suatu sistem sel elektrolisis berbanding lurus dengan muatan listrik yang mengalir dalam sel tersebut. Besarnya muatan listrik yang terjadi dalam sel merupakan hasil kali antara kuat arus yang dialirkan dengan lamanya waktu elektrolisisnya. Pernyataan ini merupakan prinsip dasar Hukum Faraday yang dapat dijelaskan sebagai berikut:
1. Dalam sel elektrokimia, massa zat yang diendapkan pada suatu elektrode sebanding dengan besarnya muatan listrik (aliran elektron) yang terlibat di dalam sel.
2. Massa ekuivalen zat yang diendapkan pada elektrode akan setara dengan muatan listrik yang dialirkan ke dalam sel.
Secara aljabar hukum Faraday I dapat diformulasikan sebagai berikut:
w = (e i t)/F
w = massa zat, gram
e = massa ekuivalen atau (M/valensi)
i = kuat arus, ampere
F = tetapan Faraday = 96.500 coulumb
1 F = satu mol elektron
Contoh Perhitungan Hukum Faraday Pada Sel Elektrolisis
Berapakah massa tembaga yang diendapkan di katode pada elektrolisis larutan CuSO4 dengan menggunakan kuat arus 2 A selama 20 menit. (diketahui bahwa massa atom relatif tembaga adalah ArCu = 63,5 g/mol)
Jawab
Di katode akan terjadi reaksi reduksi ion Cu2+ menjadi logam Cu seperti reaksi berikut:
Cu2+(aq) + 2 e– –>Cu(s)
Pada Reaksi ini, ion-ion Cu2+ yang terdapat dalam larutan akan tereduksi kemudian terendapkan dan membentuk tembaga logam pada katoda. Jumlah tembaga logam yang terendapkan akan tergantung pada lamanya dan arus yang digunakan.
e = (63,5 g/mol)/2
t = 20 menit = 1.200 s
w =( e i t)/ F
w = { [(63,5 g/mol)/2] × 2 A ×1.200 s}/96.500 coulumb
= 0,79 g
Dengan demikian, massa tembaga yang diendapkan pada katode adalah 0,79 gram
Ikatan kimia
Ikatan kimia
KD. 3.5-4.5
MATERI: IKATAN KIMIA
KELAS : X IPA 4
Pertemuan : 2
Teori Lewis: Teori tentang Ikatan Kimia

Teori tentang ikatan kimia lahir dari gagasan Profesor Fisika dan Kimia dari Amerika Serikat yaitu Gilbert. N. Lewis. Dalam artikelnya di tahun 1916 tentang “The atom and the molecules”, Lewis meneliti tentang kesulitan golongan gas mulia (VIIIA) membentuk suatu ikatan kimia. Diduga bila gas mulia bersenyawa dengan unsur lain, tentunya ada suatu keunikan dalam konfigurasi elektronnya yang dapat mencegah persenyawaan dengan unsur-unsur lain.
Apabila dugaan tersebut benar, maka suatu atom yang bergabung dengan atom lain membentuk suatu senyawa yang mungkin mengalami perubahan dalam konfigurasi elektronnya sehingga mengakibatkan atom-atom tersebut lebih menyerupai gas mulia. Berdasarkan gagasan itu, lahirlah suatu teori yang disebut Teori Lewis, yaitu:
a. Elektron-elektron yang berada pada kulit terluar (dikenal sebagai elektron valensi)memegang peranan utama dalam pembentukan ikatan kimia.
b. Pembentukan ikatan kimia mungkin terjadi dengan 2 cara:
- Karena adanya perpindahan satu atau lebih elektron dari satu atom ke atom lain sedemikian rupa sehingga terdapat ion positif dan ion negatif dan keduanya saling tarik-menarik karena muatannya yang saling berlawanan akan membentuk ikatan ion.
- Karena adanya pemakaian bersama pasangan elektron di antara atom-atom yang berikatan. Jenis ikatan yang terbentuk disebut ikatan kovalen.
c. Perpindahan elektron atau pemakaian bersama pasangan elektron berlangsung sedemikian rupa sehingga setiap atom yang berikatan mempunyai suatu konfigurasi elektron yang stabil yaitu konfigurasi dengan 8 elektron valensi.
Jenis-jenis Ikatan Kimia

Ikatan kimia terdiri dari 3 jenis ikatan yaitu ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan ionadalah ikatan yang terjadi berdasarkan serah terima atau perpindahan elektronnya, ikatan ini terjadi antara ion positif dan ion negatif dan juga antara unsur logam dan non logam, serta antara unsur golongan IA dan IIA (+), golongan VIA dan VIIA(-). Contoh senyawa ion antara lain: NaCl, MgCl2, CaCl2, KOH, KCl, dan lainnya.
Ikatan kovalen adalah ikatan yang terjadi berdasarkan pemakaian pasangan elektron bersama, ikatan ini terjadi antara unsur non-logam dan non-logam. Ikatan kovalen memiliki 3 jenis yaitu ikatan kovalen biasa, ikatan kovalen rangkap, dan ikatan kovalen koordinat. Contoh ikatan kovalen antara lain: H20, HF, HCl, CO2, NH3, Cl2, I2, Br2, O2, dan lainnya.
Ikatan logamadalah ikatan yang terjadi antar atom-atom unsur logam. Ikatan ini terjadi antara elektron valensi logam yang membentuk elektron valensi. Ikatan logam dapat menjadikan suatu logam yang keras namun lentur, tidak mudah patah meski ditempa, titik leleh dan titik didih yang tinggi, dan nilai konduktor listrik dan panas yang baik.
Contoh dari jalan terjadinya ikatan ion adalah saat Atom Natrium berikatan dengan atom Clorida dan saat Calsium berikatan dengan Sulfurida. Konfigurasi elektronnya adalah sebagai berikut:
1. Atom Natrium berikatan dengan atom Clorida dan saat Calsium berikatan dengan Sulfurida
11Na → 2 8 1 (Na akan membentuk ion positif dan memberi elektron kepada Cl agar mencapai kestabilan)
17Cl → 2 8 7 ( Cl akan membentuk ion negative dan menerima elektron dari Na agar mencapai kestabilan)
Reaksi yang dapat dituliskan:
Na → Na+ + e 2 . 8
Cl + e → Cl– 2. 8. 8
Rumus Molekul:
Na+ + Cl– → NaCl(Hasil akhir adalah terbentuknya senyawa NaCl yangstabil)
17Cl → 2 8 7 ( Cl akan membentuk ion negative dan menerima elektron dari Na agar mencapai kestabilan)
Reaksi yang dapat dituliskan:
Na → Na+ + e 2 . 8
Cl + e → Cl– 2. 8. 8
Rumus Molekul:
Na+ + Cl– → NaCl(Hasil akhir adalah terbentuknya senyawa NaCl yangstabil)
2. Atom Ca berikatan dengan atom S
Konfigurasi elektronnya adalah sebagai berikut:
20Ca → 2 8 8 2 ( Ca akan membentuk ion positif dan memberi elektron kepada S agar mencapai kestabilan).
16S → 2 8 6 ( S akan membentuk ion negatif dan menerima elektron dari Ca agar mencapai kestabilan).
Reaksi yang dapat dituliskan:
Ca → Ca2+ + 2e 2 . 8. 8
S + 2e → S2- 2. 8. 8
Rumus Molekul:
Ca2++ S2- → CaS (Hasil akhir adalah terbentuknya senyawa CaS yang stabil)
20Ca → 2 8 8 2 ( Ca akan membentuk ion positif dan memberi elektron kepada S agar mencapai kestabilan).
16S → 2 8 6 ( S akan membentuk ion negatif dan menerima elektron dari Ca agar mencapai kestabilan).
Reaksi yang dapat dituliskan:
Ca → Ca2+ + 2e 2 . 8. 8
S + 2e → S2- 2. 8. 8
Rumus Molekul:
Ca2++ S2- → CaS (Hasil akhir adalah terbentuknya senyawa CaS yang stabil)
Jenis-jenis Ikatan Kovalen

Penulisan suatu ikatan kovalen didasarkan pada rumus Lewisdan rumus bangun/struktur molekul. Rumus lewis (rumus elektron)adalah rumus yang menggambarkan bagaimana keadaan elektron-elektron valensi atom-atom saling berpapasan dan saling berikatan secara kovalen. Sedangkan rumus bangun (struktur molekul)adalah rumus yang menggambarkan bagaimana cara ikatan kovalen yang digunakan atom-atom.
Langganan:
Postingan (Atom)





