KD. 3.5-4.5
Materi : ikatan kimia "bentuk molekul "
Pertemuan ke : 4
Kelas : X IPA 4
Bentuk Molekul Teori Domain Elektron
Metode yang dapat digunakan untuk meramalkan bentuk molekul adalah model rumus titik elektron yang diperluas menjadi teori domain elektron atau teori tolakan pasangan elektron kulit valensi (VSEPR, Valence Shell Electron Pair Repulsion). Seperangkat aturan dikemas ke dalam teori domain elektron yang memungkinkan Anda dapat meramalkan bentuk molekul secaratepat. Teori ini didasarkan pada jumlah pasangan elektron ikatan dan pasangan elektron bebas dalam kulit valensi atom pusat suatu molekul. Teori ini menyatakan bahwa bentuk molekul dapat ditentukan berdasarkan tolakan pasangan elektron dalam kulit valensi atom pusat. Oleh karena itu, teori ini disebut domain elektron atau VSEPR. Bagaimana teori ini dapat diterapkan untuk memprediksi bentuk suatu molekul? Untuk mempermudah mempelajarinya, molekul-molekul dikelompokkan ke dalam tiga kategori, yaitu molekul-molekul yang memiliki atom pusat:
1. berikatan kovalen tunggal yang jenuh;
2. berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas);
3. berikatan kovalen rangkap.
2. berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas);
3. berikatan kovalen rangkap.
Dalam teori VSEPR, gaya tolakan yang dihasilkan PEB juga mempengaruhi bentuk mlekul. Notasi VSEPR yang menunjukan jumlah PEI dan PEb sebagai berikut:

Hubungan antara PEI dan PEB pada atom pusat terhadap bentu molekul disajikan dalam tabel berikut ini.

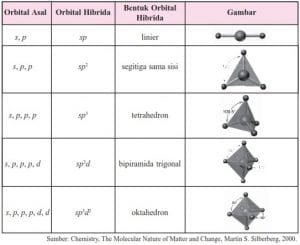
Teori Hibridilasi
Teori hibridilasi dijelaskan berdasarkan proses penggabungan orbital-orbital atom yang digunakan oleh elektron-elektron yang saling berikata. Teori ini disebut juga teori ikatan valensi.
a. Orbital Hibrida sp
b. orbital sp2
c. orbital sp3
d. orbital sp3d dan sp3d2
b. orbital sp2
c. orbital sp3
d. orbital sp3d dan sp3d2
Secara ringkas berbagai tipe hibridasi digambarkan seperti tabel dibawah ini.
Tidak ada komentar:
Posting Komentar